下列关于原子结构、元素性质的说法正确的是( )
| A.同种元素的原子可以有不同的中子数 |
| B.同主族元素从上到下,单质的熔点逐渐降低 |
| C.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应的水化物的酸性越强 |
| D.非金属元素组成的化合物中只含共价键 |
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断完成下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式___________、___________、___________、___________。
(2)C与D形成D的最低价化合物的电子式:______________________。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:____________________________________________。
下列说法中,不正确的是()
A.在NaAlO2溶液中,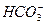 不可能大量存在 不可能大量存在 |
| B.在0.1 mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小 |
| C.在由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中,Al3+不可能大量存在 |
| D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子 |
下列离子方程式正确的是()
A.Na2CO3溶液的水解 +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
B.金属铝溶于氢氧化钠溶液 Al+2OH-  +H2↑ +H2↑ |
C.铜与浓硝酸反应 3Cu+8H++2  3Cu2++2NO↑+4H2O 3Cu2++2NO↑+4H2O |
D.次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O==== +HClO +HClO |
下列离子方程式正确的是()
| A.氯化铝溶液与氨水反应: Al3++3NH3·H2O====Al(OH)3↓+3 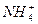 |
| B.磷酸二氢钙溶液跟足量的氢氧化钠溶液混合: 3Ca2++ 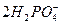 z4OH-====Ca3(PO4)2↓+4H2O z4OH-====Ca3(PO4)2↓+4H2O |
| C.硝酸亚铁溶液中滴入稀硫酸: Fe2++ 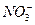 +2H+====Fe3++NO↑+2H2O +2H+====Fe3++NO↑+2H2O |
| D.硫氢化钠水解: |
HS-+H2O====H2S↑+OH-
经测定,某溶液中只含有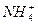 、Cl-、H+、OH-四种离子,下列说法中错误的是()
、Cl-、H+、OH-四种离子,下列说法中错误的是()
A.溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(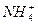 )>c(OH-) )>c(OH-) |
B.若溶液中的溶质是NH4Cl和NH3·H2O,则粒子浓度大小:c(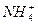 )>c(Cl-)>c(NH3·H2O)>c(H+)可能正确 )>c(Cl-)>c(NH3·H2O)>c(H+)可能正确 |
C.若溶液中四种离子满足:c(Cl-)>c(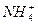 )>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl )>c(H+)>c(OH-),则溶液中的溶质一定只有NH4Cl |
D.若溶液中c(Cl-)=c(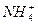 ),则该溶液呈中性 ),则该溶液呈中性 |