25℃和101kPa时,乙烷、乙炔(C2H2)组成的混合烃32mL与过量的氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,则原混合烃中乙烷的体积分数为( )
| A.75% | B.12.5% | C.50% | D.25% |
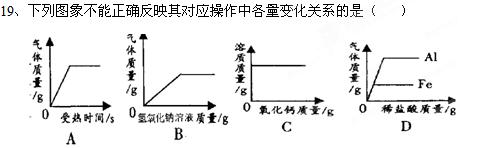
| A.用一定质量的高锰酸钾加热制氧气 |
| B.向一定质量的硫酸铵溶液中加入过量的氢氧化钠溶液 |
| C.向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 |
| D.分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量 |
“凯式定氮法”是通过测奶品中含氮量(氮元素的质量分数)来折算奶品中蛋白质含量的一种方法。为了提高氮的含量,不法分子将三聚氰胺(化学是为C3H6N6)添加进奶品中,冒充蛋白质,使许多婴幼儿长期服用后产生结石,严重影响婴幼儿的健康。不法分子如果向1000g牛奶中添加2.52g三聚氰胺,能够冒充蛋白质的质量为(已知蛋白质中所含氮元素的质量分数约为16%)()
| A.2.52g | B.4.44g | C.10.5g | D. 12.32g 12.32g |
下列变化前后的数据关系不符合a > b的是()
| A.一瓶浓硫酸溶质的质量分数为a,敞口放置一段时间后溶质质量分数为b |
| B.一瓶浓盐酸的质量为a,敞口放置一段时间后质量为b |
| C.将锌片放置在质量为a的硫酸铜溶液中,一段时间后,溶液质量为b |
| D.酒精和水混合前的体积之和为a,混合后总体积为b |
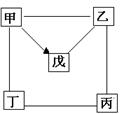
下图中“—”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件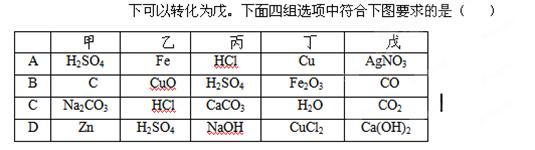
制作“叶脉书签”需配制l00 g 12%的NaOH溶液(设水的密度为 1g/mL)。下列操作中正确的是()
| A.称量前调节天平平衡时发现指针向右偏转,可调节游码 |
| B.在左右托盘上垫滤纸称取l2.0gNaOH固体 |
| C.将准确称取的NaOH固体直接倒入装有水的量筒中溶解 |
| D.选用100 mL的量筒量取88mL的水 |