NA为阿伏加德罗常数,下列叙述错误的是
| A.标准状况下,1molSO3的体积约为22.4L |
| B.100mL0.10 mol·L-1AlCl3溶液中,Cl-的数目为0.03NA |
| C.18g水中,电子的数目为10NA |
| D.3molCu与稀硝酸完全反应,被还原的NO3-数目为2NA |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是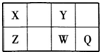
| A.钠与W可能形成Na2W2化合物 |
| B.由Z与Y组成的物质在熔融时能导电 |
| C.W得电子能力比Q强 |
| D.X有多种同素异形体,而Y不存在同素异形体 |
根据键能数据估算CH4 (g)+4F2 (g) =CF4+4HF(g)的反应热ΔH为
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能/(kJ/mol) |
414 |
489 |
565 |
155[ |
A.–1940 kJ · mol-1B.+1940 kJ · mol-1
C.–485 kJ · mol-1D.+485 kJ · mol-1
用价层电子对互斥理论(VSEPR)预测H2S和COCl2的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
下列说法中错误的是
| A.根据对角线规则,铍和铝的性质具有相似性 |
| B.在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.P4和CH4都是正四面体分子且键角都为109o28ˊ |
下列说法错误的是
| A.s轨道呈圆形,p轨道呈哑铃形 |
| B.Cu元素在元素周期表的ds区 |
| C.1.5g CH3+中含有的电子数为0.8NA |
| D.DNA中的碱基互补配对是通过氢键来实现的 |