下列物质的电子式书写正确的是
A.NaCl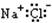 |
B.H2S 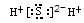 |
C.NF3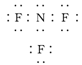 |
D.NH4I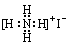 |
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是
| A.单质的氧化性按X、Y、Z的顺序增强 |
| B.阴离子的还原性按X、Y、Z的顺序减弱 |
| C.气态氢化物的稳定性按X、Y、Z的顺序增强 |
| D.元素非金属性按X、Y、Z的顺序减弱 |
元素性质呈现周期性变化的根本原因是
| A.元素的相对原子质量递增,量变引起质变 |
| B.元素原子的核外电子排布呈周期性变化 |
| C.元素的原子半径呈周期性变化 |
| D.元素的化合价呈周期性变化 |
下列物质中,只含有离子键,不含有共价键的是
| A.HCl | B.KOH | C.CaCl2 | D.CO2 |
下列各组粒子中属于同位素的是
| A.16O和18O | B.H2O和D2O | C.H2和D2 | D.24Mg和24Na |