"江北水乡﹒运河古城"是今日枣庄的城市名片,而她又素以"煤城"著称。煤是一种重要的能源,工业上常把煤进行气化和液化处理,变为清洁能源。煤的气化和液化流程如下图所示:

【查阅资料】水煤气是混合气体,由两种无色无味的气体组成,可以燃烧。
【提出问题】水煤气是什么?
【猜想假设】根据资料和反应物判断,水煤气可能是:①一氧化碳和氢气;②二氧化碳和氢气。
(1)提出以上猜想的依据是。
【设计实验】请从下列装置中选择一种,设计简单的实验证明猜想。

(2)你选择的装置是(填字母代号),可能的现象为。
【实验结论】(3)那么,猜想(填序号)是合理的。
实验室中有一瓶标签破损的固态铵盐,它可能是
、
、
、
中的一种,请利用下图所示的溶液进行实验探究.
【提出猜想】猜想①:该铵盐是
猜想②:该铵盐是猜想③:该铵盐是
猜想④:该铵盐是
【实验探究】步骤一:取少量样品放入试管中,没有嗅到强烈的氨味,加入适量水溶解得到无色液体,选用图中的溶液滴入试管中,无气泡放出,则猜想③不成立.
步骤二:在步骤一所得的溶液中,滴加图中的
溶液,没有白色沉淀生成,则猜想不成立.
步骤三:另取适量样品放入试管中,加水溶解配成溶液,滴加图中的溶液,有白色沉淀生成,则猜想成立.
【拓展应用】铵盐可作氮肥,它会与碱性物质发生化学反应,请写出硝酸铵溶液与氢氧化钠溶液在加热条件下反应的化学方程式,所以在农业生产中,为避免降低肥效,铵态氮肥不要与碱性物质混合施用.
以下是我们日常生活中常用各种清洗剂,选择适当的用品可以得到更好的清洗效果.
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
污渍爆炸盐 |
漂白粉 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过碳酸钠 |
消毒 |
(2)以下物质可以使用洁厕灵清洗的是填字母序号).
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
(3)取上述一定量的炉具清洁剂,滴加几滴酚酞溶液,溶液变色,若将洁厕灵与炉具清洁剂混合,可以发生右图所示的化学反应.图中a微粒的化学式为.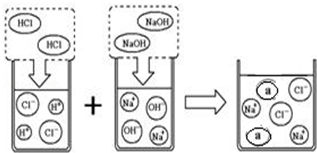
(4)"污渍爆炸盐"溶于水后会生成
和
.将爆炸盐溶于水后,再加入足量的洁厕灵,发生的化学反应方程式为.
(5)化学小组发现一袋包装破损的漂白粉,同学们对漂白粉其漂白作用是否失效产生了疑问.(当有效成分完全消失时,则漂白粉就完全失效;部分消失时,则为部分失效).
I.查阅资料:
①漂白粉的主要成分是
、
和
,其有效成分是
.
②
可溶于水,漂白原理是:它在空气中发生反应:
,
③
不稳定,易分解生成
和一种常见的单质气体.
④
的水溶液呈中性,
的水溶液呈酸性.
⑤
能可使有色物质(如:品红溶液)褪色.
II.交流讨论:
该小组同学经过分析得出
分解时除生成
外,生成的另一种常见气体是 .
III.实验探究:下表是探究某漂白粉是否完全失效的实验,请根据表中结论,进行填空.
| 实验步骤 |
实验现象 |
实验结论 |
| 把少量漂白粉样品加入水中,通入足量的
气体, _ . |
. |
漂白粉的漂白作用已完全失效. |
猜想一
和
;猜想二: ;
小明同学认为猜想中的成分
,除漂白粉的有效成分在空气中发生反应生成外,还有其它来源,请你用化学方程式表示 .
小聪同学进行实验证明失效后的漂白粉的成分符合猜想一,而与猜想二不符.小聪同学的实验方案是: .
某学习小组的同学在做碳酸钠溶液和澄清石灰水反应的实验后,将反应后的浑浊液进行过滤,得到澄清的滤液,对于滤液的组成同学们做出如下猜想:
【猜想与假设】大家一致认为滤液中一定有氢氧化钠,生成氢氧化钠的化学方程式是;小明猜想还可能有氢氧化钙,小丽猜想还可能有氢氧化钙和碳酸钠,你还能做出的猜想是.
【活动与探究】请你设计一个实验方案验证你的猜想.
| 实验步骤 |
实验现象 |
实验结论 |
(1);
(2).
在学完"二氧化碳性质的探究"后,小明同学觉得按照课本实验(图①)不能完全说明是什么物质使紫色石蕊溶液变红色,他和小娜同学进行了如下实验探究: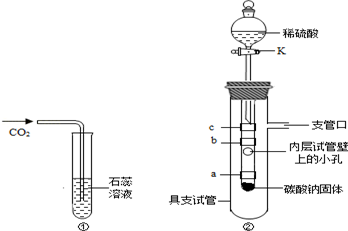
【猜想与假设】
猜想一:水使紫色石蕊溶液变红
猜想二:二氧化碳使紫色石蕊溶液变红
猜想三:二氧化碳与水反应生成的新物质使紫色石蕊溶液变红
【查阅资料与实验准备】
(1)将纸条浸泡在紫色石蕊溶液中,晾干后可制得紫色石蕊试纸.
(2)自制的紫色石蕊试纸遇酸变红色,遇碱溶液变蓝色.
【设计与实验】
小明同学设立了实验装置如图②.
图中
紫色石蕊试纸,缠绕在小试管上.
(1)猜想不正确.
(2)打开活塞
,滴入稀硫酸,观察并解释实验现象:
①试纸
没有明显变化,得出结论:猜想不正确.
②试纸
由紫色变为红色,得出结论:(用化学方程式表示)猜想正确.
③试纸首先变色,其原因是.
【交流与反思】
小娜同学认为,上图装置还可以同时验证:①二氧化碳能使澄清石灰水变浑浊;②二氧化碳不能燃烧不支持燃烧.
为了完成小娜同学的两个验证实验,请你对上面的实验装置进行简单的改进:.
为了探究溶质在水中溶解速率的影响因素,某学习小组设计了如下实验:
下列说法中正确的是()
| A. | 对比实验①和②,可探究水的温度对溶质在水中溶解速率的影响. |
| B. | 对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响. |
| C. | 对比实验②和③,可探究固体溶质的形态对溶质在水中溶解速率的影响. |
| D. | 对比实验①和③,可探究固体溶质的形态对溶质在水中溶解速率的影响. |