常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是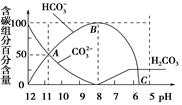
| A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-) |
| B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.0.05 mol/L NaHCO3溶液的pH=8 |
食品安全备受社会关注。下列符合食品安全要求的是
| A.酱油中添加含铁的营养强化剂 | B.饮料中添加塑化剂 |
| C.用甲醛浸泡海鲜 | D.用工业盐腌制腊肉 |
普及化学知识有助于人们树立健康的观念。下列观念正确的是
| A.天然物质都是绿色无毒的物质 |
| B.只饮用纯净水有益人体健康 |
| C.微量元素只能通过保健品摄入 |
| D.禁止吸烟可减少室内空气污染 |
下列物质中不会引起室内空气污染的是
| A.水果释放出的酯类物质 |
| B.厨房烧饭时产生的油烟 |
| C.地板砖中释放出的氡等放射性物质 |
| D.室内装潢涂料中释放出来的苯、二甲苯 |
下列物质中,属于目前世界上用量最大、用途最广泛的合金是
| A.青铜 | B.钢材 | C.18K金 | D.钛合金 |
空气质量状况监测中,不需要监测的指标是
| A.可吸入颗粒物(PM10) | B.NO2浓度 |
| C.SO2浓度 | D.CO2浓度 |