在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)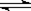 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
现有盐酸、熟石灰、烧碱、食盐四种物质,其中能用于金属除锈的是__________________,能用于改良酸性土壤的是__________________.
对溶解度受______________变化影响不大的固体物质一般用______________方法得到固体溶质,例如从海水中提取______________;对溶解度受______________变化影响相当大的固体溶质一般用______________的方法得到固体.
在实验室配制溶液时,常涉及以下过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解.
请按要求回答下列问题:
(1)甲同学用氯化钠和蒸馏水配制50 g 5%的氯化钠溶液.正确的操作顺序是:___________________.(用以上序号填空)现实验室中有10mL,50mL,100mL等不同规格的量筒,配制 上述溶液时最好选用_______mL的量筒.
(2)乙同学用10g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50g,5%的氯化钠溶液.正确的操作顺序是:____________________________.(用以上序号填空)
t1℃时硝酸钠的饱和溶液的质量分数为20%,已知t 2 ℃硝酸钠的溶解度为t 1 ℃时的溶解度的三倍,则t 2 ℃时硝酸钠饱和溶液的质量分数为______________.
将50 g 25%的氯化钾溶液与40 g 5%的氯化钾溶液混合所得溶液的质量分数为______________;若用20%和10%的氯化钾溶液配制200g12%的氯化钾溶液,需20%的氯化钾溶液__________g,10%的氯化钾溶液______________g.