某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/ mol·L-1 |
0.010 |
0.020 |
0.020 |
| c(CO2) / mol·L-1 |
0.010 |
0.010 |
0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中CO2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
常温下,有关醋酸溶液的叙述中正确的是
| A.用pH 计测得0.1 mol·L-1的CH3COOH溶液的 pH约2.9,说明CH3COOH是弱酸 |
B.将pH=3的醋酸稀释为pH=4的过程中,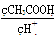 比值不变 比值不变 |
| C.向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,CH3COOH和H2O的电离程度都减小 |
| D.pH=3的醋酸和盐酸分别与pH=11的NaOH溶液完全中和,两者消耗NaOH溶液的体积相同 |
短周期元素W、X、Y、Z的原子序数依次增大,W、X的最外层电子数之比为4︰3,Y原子的最外层电子数是次外层电子数的一半,Z元素原子的半径在同周期元素原子中最小。下列叙述正确的是
| A.W、X、Y的最高价氧化物都能与NaOH溶液反应,它们都属于酸性氧化物 |
| B.W、Y、Z三种元素简单气态氢化物的热稳定性为: Z>W>Y |
| C.Z元素最高价氧化物对应的水化物的化学式为HZO3 |
| D.原子半径的大小顺序为:rY>rW>rX |
在下述条件下,一定能大量共存的离子组是
| A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4- |
| B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br- |
| D.强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-===CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
下列物质转化在给定条件下不能实现的是
①SiO2 Na2SiO3
Na2SiO3 H2SiO3
H2SiO3
②S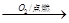 SO3
SO3 H2SO4
H2SO4
③饱和NaCl(aq) NaHCO3
NaHCO3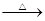 Na2CO3
Na2CO3
④Fe2O3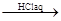 FeCl3(aq)
FeCl3(aq)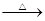 无水FeCl3
无水FeCl3
⑤MgO MgCl2溶液
MgCl2溶液 Mg
Mg
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |