下列反应的离子方程式不正确的是( )
A.Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2+ + 6OH-+2Al3++3SO42-="3" BaSO4↓+ 2Al(OH)3↓
B.FeCl3溶液中加入过量Na2S溶液: 2Fe3++S2- = 2Fe2+ + S↓
C苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O
关于下图所示装置的叙述,错误的是
| A.锌是负极,其质量逐渐减小 | B.氢离子在铜表面被还原,产生气泡 |
| C.电流从锌片经导线流向铜片 | D.电子从锌片经导线流向铜片 |
C、CO、CH4、C2H5OH是常用的燃料,它们每1 mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5 kJ、110.5 kJ、890.3 kJ、1366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是
A.C B.CO C.CH4D.C2H5OH
工业制硫酸中的一步重要反应是SO2在400-600 ℃下的催化氧化:
2SO2+O2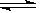 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A使用催化剂是为了加快反应速率,提高生产效率
B在上述条件下,SO2不可能100%地转化为SO3
C为了提高SO2的转化率,应适当提高O2的浓度
D达到平衡时,SO2的浓度与SO3的浓度相等
下列各组材料中,不能组成原电池的是
| A |
B |
C |
D |
|
| 两极材料 |
Zn片、石墨 |
Cu片、Ag片 |
Zn片、Cu片 |
Fe片、Cu片 |
| 插入溶液 |
H2SO4溶液 |
AgNO3溶液 |
蔗糖溶液 |
稀盐酸 |
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100 kPa时,1 mol石墨转化为金刚石,要吸收1.895 kJ的热能。据此,试判断在100 kPa压强下,下列结论不正确的是
| A.石墨比金刚石稳定 | B.金刚石比石墨稳定 |
| C.1 mol石墨比1 mol金刚石的总能量低 | |
| D.金刚石转化为石墨要放出能量 |