(10分)、有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)有机物A的相对分子质量为: 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况)。 |
(2)9.0g有机物A完全燃烧时,经计算:生成CO2共为 mol, 生成的H2O g。 有机物A的分子式 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(4)A的结构简式 。 |
| (4)有机物A可跟乙酸发生酯化反应,其质量比为3:2;有机物A也可跟乙醇发生酯化反应,其物质的量比为1:1;且酯化反应分别发生在链中和链端。 |
|
| (5)有机物A可否发生缩聚反应?若能,请直接写出反应的化学方程式;若不能,请指出原因 |
糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合症,以高血糖为主要标志。长期摄入高热量食品和缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为Ca(H2O)6,则每个葡萄糖分子含有6个H2O
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇【结构简式为:CH2 OH(CHOH)3CH2OH】是一种甜味剂,糖尿病人食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有种同分异构体。
(3)糖尿病人不可饮酒,酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60。
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子的个数比为1:3。
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入溶液,发现有气泡冒出;
写出A与酒精反应的化学方程式。
(4)糖尿病人宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质。下列说法正确的是。
A.蛋白质溶液遇碘单质会变蓝色
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含水解纤维素的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质溶液遇浓硝酸变黄,称为蛋白质的显色反应
E.工业上常利用蛋白质的皂化反应来制取肥皂
(12分)A、B、C、D、E是除稀有气体以外的的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置_______________,C元素是__________(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):__________________
(3)A和D形成的含18电子化合物的化学式为___________________
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为: ________________________________________________
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:_________________________________________
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2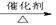 2CH3COOH。
2CH3COOH。
③已知乳酸F的结构简式为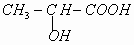 。.
。.
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示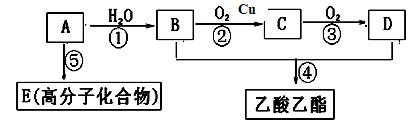
回答下列问题:
(1)E的结构简式为
(2)F分子中含________和_________两种官能团(写名称)
(3)验证D和F兼有的官能团常采用的试剂是,产生的现象为
(4)写出下列反应的反应类型:①,④。
(5)写出下列反应的化学方程式:
①;
②;
③F与金属钠反应的化学方程式为
雷尼镍(RAney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:AlMg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: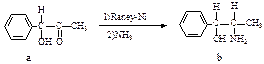
化合物b中除苯环外的C原子、O原子、N原子进行的杂化的形式分别是:、、。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:(选填序号:a.氯化钠 b. 金刚石 c.石英 d. 氯化铯)。其中心原子配位数为。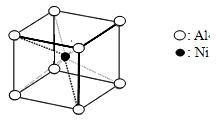
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni在基态时,核外电子排布式为:。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题: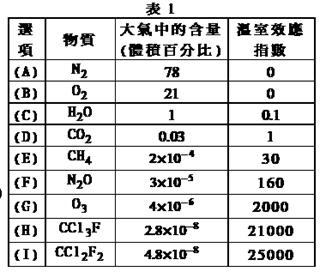
(1)下列由极性键形成的非极性分子是。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手 性异构
性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为:。