下图是100 mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识填空: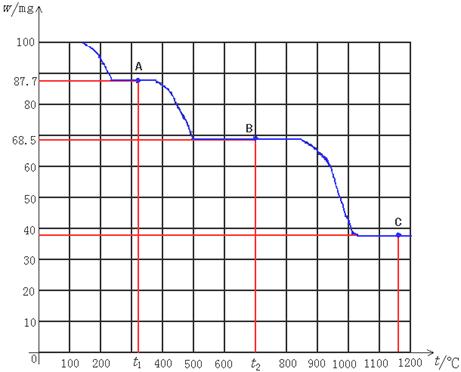
(1)温度分别为t1和t2时,固体产物的化学式A是________,B是________。产物C的化学式为 。
(2)由A得到B的化学方程式为___________________________________。
如图为宇宙中有一个恒星系的示意图。A为星系的一颗行星,它绕中央恒星O运行的轨道近似为圆。天文学家观测得到A行星运动的轨道半径为 、周期为
、周期为 。
。
(1)中央恒星O的质量为多大?
(2)经长期观测发现,A行星实际运动的轨道与圆轨道总存在一些偏离,且周期性地每隔时间 发生一次最大的偏离。天文学家认为形成这种现象的原因可能是A行星外侧还存在着一颗未知的行星B(假设其运行轨道与A在同一水平面内,且与A的绕行方向相同),它对A行星的万有引力引起A轨道的偏离。(由于B对A的吸引而使A的周期引起的变化可以忽略)根据上述现象及假设,试求未知行星B的运动周期T及轨道半径R。
发生一次最大的偏离。天文学家认为形成这种现象的原因可能是A行星外侧还存在着一颗未知的行星B(假设其运行轨道与A在同一水平面内,且与A的绕行方向相同),它对A行星的万有引力引起A轨道的偏离。(由于B对A的吸引而使A的周期引起的变化可以忽略)根据上述现象及假设,试求未知行星B的运动周期T及轨道半径R。
在半径R="5000" km的某星球表面,宇航员做了如下实验,实验装置如下图甲所示.竖直平面内的光滑轨道由轨道AB和圆弧轨道BC组成,将质量m="0.2" kg的小球,从轨道AB上高H处的某点静止滑下,用力传感器测出小球经过C点时对轨道的压力F,改变H 的大小,可测出相应的F大小,F随H 的变化关系如图乙所示,求:
(1)该星球表面的重力加速度;
(2)该星球的第一宇宙速度.
质量为m=2kg的物体静止在水平面上,它们之间的动摩擦系数μ=0.5, 现在对物体施加以如图所示的拉力F="10N" ,与水平方向夹角θ=37º(sin37º=0.6),经t=10s后撤去力F,在经一段时间,物体又静止.
求:(1)物体运动过程中最大速度多少?
(2)物体运动的总位移是多少?(g取10m/s2)
今有一包硫酸钠和硫酸铵的混合物,将其溶于水中配成500mL溶液,取出25mL加入足量BaCl2溶液充分反应后过滤,得到干燥沉淀6.99g;另取25mL加入足量的NaOH溶液并加热,得到标况下的气体896mL。求:
(1)原固体中硫酸钠和硫酸铵的物质的量分别是多少?
(2)所配溶液中硫酸根离子的物质的量浓度是多少?
100mL 2mol/L的溴化钠溶液中通入一定量氯气后,将溶液蒸干得到固体16.15g。
求(1)通入的氯气在标况下的体积是多少 ?
(2)所得固体的成份及各自物质的量