通常情况下能共存,且能用浓硫酸干燥的一组气体是
| A.H2 O2 N2 | B.O2 NO NO2 |
| C.H2 N2 NH3 | D.NH3 HCl NO2 |
下列化合物中,只能在水溶液中才能导电的电解质是
| A.NaCl | B.H2SO4 | C.NH3 | D.CaO |
下列说法正确的是
| A.可用丁达尔现象区分溶液与胶体 |
| B.化学变化能够实现一种原子变为另一种原子 |
| C.O3是由3个氧原子构成的化合物 |
| D.CuSO4•5H2O是一种混合物 |
下列各组物质,前者是混合物,后者是纯净物的是
| A.水玻璃 玻璃 | B.石油 盐酸 |
| C.干冰 铝热剂 | D.氯水 液氯 |
25 ℃、101 kPa下:①2Na(s)+1/2O2(g)===Na2O(s) ΔH1=-414 kJ/mol
②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ/mol
下列说法不正确的是
| A.①和②产物的阴阳离子个数比相等 ,均为1:2 |
| B.①和②生成等物质的量的产物,转移电子数相同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ/mol |
2SO2(g) + O2(g)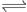 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是
| 甲 |
乙 |
丙 |
||
| 起始物质的量(mol) |
n(SO2) |
0.4 |
0.8 |
0.8 |
| n(O2) |
0.24 |
0.24 |
0.48 |
|
| SO2的平衡转化率 / % |
80 |
α1 |
α2 |
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率