某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的分子式
| A.HX | B.H2X | C.XH3 | D.XH4 |
下列物质的转化在给定条件下能实现的是
①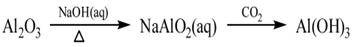
②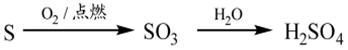
③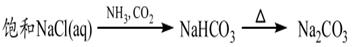
④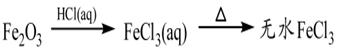
⑤
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
丙烯醇(CH2=CH-CH2OH)可发生的化学反应的组合为
①加成②氧化 ③燃烧④加聚⑤取代
| A.全部 | B.只有①②③ | C.只有①③④ | D.除⑤外 |
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得。 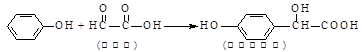
下列有关说法正确的是学
| A.该反应是取代反应 |
| B.苯酚和羟基扁桃酸是同系物 |
| C.乙醛酸不能使酸性KMnO4溶液褪色 |
| D.1 mol羟基扁桃酸能与2 mol NaOH反应 |
组成为C3H2Cl6的卤代烃,可能存在的同分异构体有
| A.3种 | B.4种 | C.5种 | D.6种 |
某有机物的结构简式是: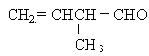 。对此有机物的下列叙述中,正确的是
。对此有机物的下列叙述中,正确的是
| A.在该有机物分子中,仅含有一种官能团 |
| B.在一定条件下该1mol有机物可与2molH2发生加成反应 |
| C.该有机物能在任何条件下都不能发生取代反应 |
| D.该有机物能与银氨溶液发生银镜反应,但不能使酸性高锰酸钾溶液褪色 |