在下列反应中,生成物能量总和高于反应物能量总和的是( )
①Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)  H=-216kJ·mol-1
H=-216kJ·mol-1
② CaCO3(s)=CaO(s)+CO2(g)  H=+178.5kJ·mol-1
H=+178.5kJ·mol-1
③ H2(g)+I2(s)=HI(g)  H=+53kJ·mol-1
H=+53kJ·mol-1
④ H+(aq)+OH-(aq)=H2O(l)  H=-57.2kJ·mol-1
H=-57.2kJ·mol-1
| A.①④ | B.②③ | C.②④ | D.①③ |
x、y为短周期元素,x原子K、L、M各电子层的电子数之比为1:4:1,它比y原子多3个电子,下列叙述正确的是( )
| A.x离子半径大于y离子半径 |
| B.x单质在空气中燃烧可生成两种化合物 |
| C.x、y形成的化合物与浓硫酸共热可在烧瓶中进行 |
| D.电解x、y形成的化合物的水溶液可得到y单质 |
已知AB、CD、EF均为1: l型离子化合物,根据下列数据判断它们的熔点由高至低的是 ( )
| 离子化合物 |
AB |
CD |
EF |
| 离子电荷数 |
1 |
1 |
2 |
| 键长(10-10m) |
2.31 |
3. 18 |
2.10 |
A.CD>AB>EFB.AB>EF>CD C.AB>CD>EFD.EF>AB>CD
下列关于杂化轨道的叙述中,正确的是()
| A.分子中中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构 |
B.CuSO4中氧原子杂化类型 有两种,分别为sp2 和sp3杂化 有两种,分别为sp2 和sp3杂化 |
| C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C分别是通过sp2 和sp3杂化轨道成键 |
| D.杂化轨道可用于形成σ键或用于形成π键 |
下列关于物质结构的说法中正确的是()
| A.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物是共价型化合物 |
| B.某元素原子最外层电子数是次外层电子数的a倍,则该原子核内质子数为a+2 |
| C.D2O分子与H2O分子是所含电子总数不相等的极性分子 |
| D.离子化合物NaxNO4中,NO4X-中的各原子最外层都达8电子稳定结构,则x=3 |
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子 不能产生NMR现象( )
不能产生NMR现象( )
A.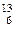 C C |
B.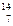 N N |
C.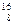 O O |
D.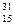 P P |