一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  Y(g)+Z(s),以下能说明反应达到平衡标志的是
Y(g)+Z(s),以下能说明反应达到平衡标志的是
| A.混合气体的压强不再变化 |
| B.X、Y、Z的物质的量之比为2:1:1 |
| C.单位时间内生成lmolY的同时分解2mol X |
| D.X的分解速率与Y的消耗速率相等 |
某密闭容器中充入一定量A、B,发生反应2A(g)+B(g)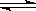 2C(g),测得C浓度与反应温度关系如图。下列说法正确的是
2C(g),测得C浓度与反应温度关系如图。下列说法正确的是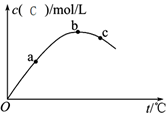
A.该反应ΔH>0 B.
B. A的转化率:a>b>c
A的转化率:a>b>c
C.平衡常数K:c>b>a D.化学反应速率:c>b>a
低脱 硝技术可用于处理废气中的
硝技术可用于处理废气中的 氮氧化物,发生
氮氧化物,发生 的化学反应为:
的化学反应为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)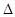 H<0
H<0
在恒容的密闭容器中,下列有关说法正确的是
| A.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
反应2A(g)  2B(g)+C(g)⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓
2B(g)+C(g)⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓 度增大,应采取的措施是
度增大,应采取的措施是
| A.减压 | B.加压 | C.降温 | D.增大B的浓度 |
在298 K、100 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)="==2HCl(g)" ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
| A.ΔH3=ΔH1-2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1+2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
已知下列两个热化学方程式,实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3 847 kJ,则混合气体中氢气与丙烷的体积比是( )
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,
C3H8(g)+5O2(g)===4H2O(l)+3CO2(g) ΔH=-2 220.0 kJ/mol。
| A.3∶1 | B.1∶3 | C.1∶4 | D.1∶1 |