将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
| A.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸 |
| B.溶液中水的电离程度:混合溶液>纯水>BOH溶液 |
| C.若混合前酸、碱pH之和等于14,则HA肯定是弱酸 |
| D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-) |
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al ② NH3
Al ② NH3 NO
NO HNO3
HNO3
③NaCl(饱和) NaHCO3
NaHCO3 Na2CO3 ④FeS2
Na2CO3 ④FeS2 SO3
SO3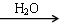 H2SO4
H2SO4
| A.②③ | B.①④ | C.②④ | D.③④ |
下列表示对应化学反应的离子方程式正确的是
| A.工业电解饱和食盐水:2Cl-+ H2O = Cl2↑+ H2↑+ OH- |
B.碳酸钠的水解:CO32-+ 2H2O H2CO3 + 2OH- H2CO3 + 2OH- |
| C.硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3·H2O===AlO+4NH4++2H2O |
| D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+ H2O2 +2H+ = I2 +2H2O |
设NA为阿伏伽德罗常数的值。下列叙述正确的是
| A.78gNa2O2固体中含有的阴离子数为NA |
| B.标准状况下,2.24L氖气所含原子数为0.2NA |
| C.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA |
| D.标准状况下,2.24L己烷含有分子的数目为0.1NA |
下列有关实验装置进行的相应实验,能达到实验目的的是

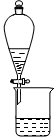

图1图2图3图4
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2所示装置可除去NO2中的NO |
| C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
下列有关物质性质的描述和该性质的应用均正确的是()
| A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏 |
| B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 |
| C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 |
| D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |