甲烷燃料电池的化学反应为CH4 + 2O2 = CO2 + 2H2O,其中1个电极反应式为
2O2 + 8H4 + 8e- = 4H2O下列叙述不正确的是( )
| A.CH4通入负极 |
| B.O2通入正极 |
| C.正极发生氧化反应 |
| D.负极的电极反应式为:CH4 + 2H2O– 8e- = CO2 + 8H+ |
下列有关判断正确的是( )
| A.0.1 mol·L-1Na2SO3溶液中有c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
| B.0.1 mol·L-1NH4Fe(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Fe3+)=c(NH4+)>c(H+)>c(OH-) |
| C.0.2 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合后有c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D.0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合得到的溶液一定呈酸性 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )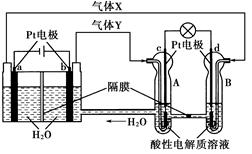
A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
下图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )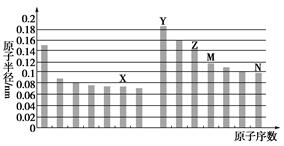
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2(SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
下列反应的离子方程式表示正确的是( )
| A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C.小苏打溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
| D.将足量的铁丝投入稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |