下列有关化学键的叙述中,不正确的是( )
| A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数 |
| B.水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子 |
| C.完全由非金属元素形成的化合物中也可能含有离子键 |
| D.配位键也具有方向性、饱和性 |
不论甲和乙以何种比例混合,通入或加入到过量的丙溶液中,一定不会有沉淀生成的是:
| 序号 |
甲 |
乙 |
丙 |
| A |
CO2 |
HCl |
Ba(OH)2 |
| B |
NO2 |
SO2 |
BaCl2 |
| C |
FeCl2 |
FeCl3 |
KSCN |
| D |
AlCl3 |
MgCl2 |
NH3·H2O |
把过量的铁粉加入到FeCl3和CuCl2组成的混合液中,充分搅拌,反应后过滤、干燥、称得不溶物的质量与加入铁粉的质量相等。则原混合物中FeCl3和CuCl2的物质的量之比是:
| A.2 :7 | B.7 :2 | C.7 :8 | D.8 :7 |
分子式为C10H14的芳香烃,分子中有4个甲基的结构有:
| A.2种 | B.3种 | C.4种 | D.5种 |
化学与生产、生活密切相关。下列有关说法中不正确的是:
| A.油脂的皂化反应一定产生甘油 |
| B.乙醇和乙酸都是常用调味品的主要成分 |
| C.医学上可用CuSO4溶液和NaOH溶液检验糖尿病人尿液中的葡萄糖 |
| D.营养物质----蛋白质、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是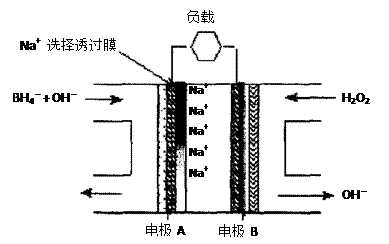
A.电极B材料中包含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应为:
BH4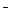 + 8OH
+ 8OH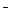 —8e
—8e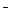 = BO
= BO + 6H2O
+ 6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶
液,理论上流过电路中的电子为6NA个