下表为周期表的一部分,其中的编号代表对应的元素。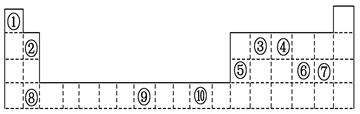
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)写出元素⑨的基态原子的电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为 对。
(4)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号)。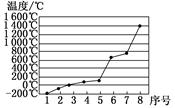
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3?H2O(1)上述溶液中,可发生水解的是(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的
顺序为。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值(填增大、
减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积④的体积(填
大于、小于、等于)。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=。
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足
量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)在25 ℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字
母,下同)__________。
A.5 B.7 C.3~5之间 D.5~7之间
(3)25 ℃时,向0.1 mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶
液pH将__________。
A.增大 B.减小 C.不变 D.无法确定
(4)室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又
不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.碳酸钠晶体 B.醋酸钠晶体 C.滴加少量硫酸铜溶液 D.水
过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)="=" 3Fe(NO3)2 + 2NO↑ + 4H2O,
①标出电子转移的方向和数目
②该反应的氧化剂是,还原产物是;
③标准状况下,当生成2.24L NO气体时, 有g Fe参加反应,转移电子的物质的量为,有mol氧化剂被还原。
已知A、B为气体单质,其中A为黄绿色气体,B为无色气体; C为化合物,其水溶液呈酸性;D为银白色金属单质,E为浅绿色溶液。它们之间有下列转化关系: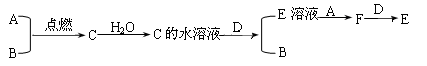
(1)试写出A、B、D、E的化学式:
A_________;B_________;D____________;E________。
(2)写出A与B反应的化学方程式:;
(3)若往E溶液中加入NaOH溶液,并露置于空气中一段时间,可观察到的现象是;
(4)E+A反应的离子方程式:;
F+D反应的离子方程式:。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式,滤渣A的主要成分为。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为_______。
(3)电解氧化铝,每生成1molAl时,生成g氧气。