(10分)某离子晶体晶胞的结构如图所示。X(·)位于立方体顶点,Y(o)位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是________。
(4)设该晶体的摩尔质量为Mg/mol,晶体密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心距离为________cm。
CO与CO2的混合气体18g,在标准状况下体积为11.2 L,其中CO2的质量为__________,CO的物质的量为__________,则混合气体的平均摩尔质量为____________。
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液里各种离子的浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数(Ksp)。
例如:Cu(OH)2 Cu2++2OH-,Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2++2OH-,Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于__________________。
(2)要使0.2 mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为__________________。
工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水。下图为离子交换膜法电解原理示意图:
请回答下列问题:
(1)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号),而两边的水不能自由流通。
①H+ ② Cl- ③Na+ ④OH-
(2)A极为电解槽的________极,电极反应式为__________________________________,
(3)如果没有阳离子交换膜,阴阳两极的某两种产物在常温下会在溶液中发生反应而使烧碱不纯,其反应的离子方程式为___________。
(4)若将标准状况下6.72L的阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,得到了两种含氯化合物,其中还原产物与氧化产物物质的量之比为5:1,写出该反应的离子方程式_____________________________________________。
某课外活动小组为了探究温度对化学平衡的影响,做了如下实验:
该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
N2O4(g) ΔH(298K)=-52.7kJ·mol-1。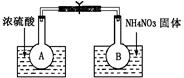
请回答:
(1)A中的现象,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向(填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
(1)常温下,0.05mol/L硫酸溶液中,c(H+)=mol/L,pH值为,水电离的c(H+)=mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。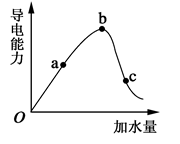
(2)“O”点为什么不导电。
(3)a、b、c三点的氢离子浓度由小到大的顺序为。
(4)a、b、c三点中,醋酸的电离程度最大的一点是。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择。
A.加NaCl溶液B.加热
C.加固体KOHD.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数