甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知: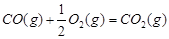
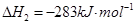
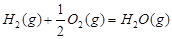

1 mol甲醇气体完全燃烧生成CO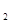 和水蒸气的热化学方程式为 。
和水蒸气的热化学方程式为 。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是 (双选)。
CH3OH(g)反应速率的是 (双选)。
| A.分离出CH3OH | B.升高温度 | C.减小压强 | D.加入合适的催化剂 |
(3)(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):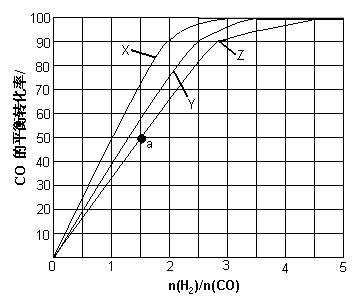
①曲线X对应的温度是 。
②从图中可以得出的结论有 (任写一条)。
(4)若往反应的容积中加入1.5molH2和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g) CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)
试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为。
(2)把1 molNa和1mol Mg分别投入到两杯体积3L浓度1mol/L的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为
 (填“”<、“>”、或“=”)。
(填“”<、“>”、或“=”)。
(3)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为mol/L。
②标准状况下,1.00L水(密度:1.00g·cm-3)吸收L的HCl可制得上述浓盐酸。
硝酸是常见的三大强酸之一,在化学研究和化工生产中有着广泛应用,常用于制备硝酸盐、染料、肥料、医药中间体、烈性炸药等。硝酸盐多用于焰火、试剂、图像处理行业。
(1)某金属M的硝酸盐受热时按下式分解:2MNO3 2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
2M+2NO2↑+O2↑,加热3.40gMNO3,生成NO2和O2折算成标准状况时的总体积为672mL。由此可以计算出M的相对原子质量为_____________。
(2)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体折算成标准状况下的体积为11.2L。其中NO的体积为_____________。
(3)现有Cu、Cu2O和CuO组成的混合物,某研究性学习小组为了探究其组成情况,加入100mL0.6mol/LHNO3溶液恰好使混合物完全溶解,同时收集到224mLNO气体(标准状况)。则产物中硝酸铜的物质的量为。如原混合物中有0.0lmolCu,则其中Cu2O与CuO的质量比为_____________。
将7.8g锌投入100mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。
(2)所用盐酸中HCl的物质的量浓度。
(3)需用多少体积的36.5%的浓盐酸(ρ =1.2g/mL)来配置上述盐酸
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入过量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入过量的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1) 原混合气体的物质的量是____________;生成沉淀的摩尔质量是____________。
(2) 原混合气体中甲烷的体积是____________,氮气的体积_________ __ 。
在标准状况下,测得8.8g某气体的体积为1.12L,计算此气体的摩尔质量。