已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。
下列说法正确的是
A.该反应的正反应的△ > 0 > 0 |
B.反应进行到5min时,b容器中 (正)= (正)= (逆) (逆) |
| C.减压可将b中的平衡组成转变成c中的平衡组成 |
| D.达到平衡时,a、b、c中C0的转化率为b>a>c |
镍镉电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd+2NiO(OH)+2H2O Cd(OH)2 +2Ni(OH)2
Cd(OH)2 +2Ni(OH)2
由此可知,该电池放电时的负极材料是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
在N2(g)+3H2(g)  2NH3(g)反应中,表示该反应速率最快的是
2NH3(g)反应中,表示该反应速率最快的是
| A.v(N2)=0.1 mol·L-1·s-1 | B.v(H2)=0.9 mol·L-1·s-1 |
| C.v(NH3)=0.8 mol·L-1·s-1 | D.v(N2)=1 mol·L-1·min-1 |
下列事实中,不能用勒沙特列原理解释的是
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 |
| C.温度过高对合成氨不利 |
| D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述正确的是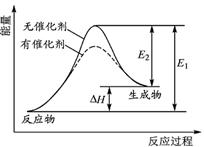
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应所需活化能,增加活化分子百分数 |
| D.逆反应的活化能大于正反应的活化能 |
下列说法中可以说明密闭容器中的反应:P(g)+Q(g) R(g)+S(g)在恒温下已达平衡状态的是
R(g)+S(g)在恒温下已达平衡状态的是
| A.反应容器内压强不随时间而变化 |
| B.P和S的生成速率相等 |
| C.反应容器内P、Q、R、S四者共存 |
| D.反应容器内总物质的量不随时间而变化 |