某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液 的变化如下图所示。下列判断正确的是( )
的变化如下图所示。下列判断正确的是( ) 
A.加适量浓NH3·H2O可使溶液由 点变到 点变到 点 点 |
B.  两点代表的溶液中 两点代表的溶液中 与 与 乘积不相等 乘积不相等 |
C.Cu(OH)2在 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的 |
下列说法在一定条件下可以实现的是 ( )
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液体系为中性
⑤有单质参加的非氧化还原反应
⑥两种氧化物反应的产物有气体
| A.①②③④⑤⑥ | B.②④⑤⑥ | C.①②③⑤ | D.③④⑤⑥ |
向100 mL NaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得固体灼烧至恒重,得到m g固体。m与通入Cl2的体积[V(Cl2),标准状况]关系如图所示。则下列说法不正确的是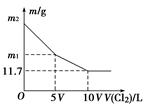
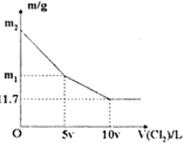
| A.V=0.224 | B.混合溶液中:c(Na+)=2 mol/L |
| C.m2=25.3 | D.m1=18.55 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是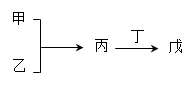

| A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
| B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
| C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |
| D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,则混合气体中一氧化碳和二氧化碳的物质的量之比是
| A.1∶3 | B.3∶1 | C.2∶1 | D.1∶2 |