A、B、C、D、E五种短周期元素。A元素所处的周期数、主族序数、原子序数均相等;B元素原子的半径是其所在主族中最小的,其最高价氧化物对应水化物的化学式为HBO3;C元素原子最外层上的电子数为内层电子数的2倍;元素D的二价阴离子与E的阳离子的核外电子排布相同;E元素的周期数比族序数多2。请回答:
(1) 写出元素的符号:A ; B____________。
(2)画出D离子的结构示意图________________________,
C在周期表的位置为 ;
(3)C的最高价氧化物的电子式是 ;
E与D的单质在常温下反应的生成物电子式为 ,E与D按原子数1∶1化合而成的物质所含化学键类型为 。
(4) A与D可形成三种电子总数为10的微粒,其中形成分子的结构式为 ,写出另二种微粒其中一种的化学式 ; A与D还可形成电子总数为18的微粒,该微粒的化学式为 。
能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量(填“相同”或“不相同”)。
现有:①二氧化碳 ②甲烷 ③二氧化硫 ④氢氧化铜。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)。
(1)天然气的主要成分是;
(2)医院化验糖尿病要用到的物质是;
(3)造成温室效应和全球气候变暖的主要物质是;
(4)泄漏到空气中而产生酸雨的主要物质是。
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ _(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加SO3的物质的量 |
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: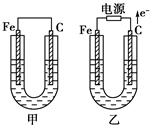
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。