下列说法正确的是:( )
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1 |
| B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
C.已知: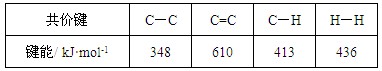 则反应 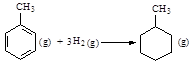 的焓变为ΔH = -384 kJ·mol-1 的焓变为ΔH = -384 kJ·mol-1 |
| D.一定浓度的NaOH溶液,温度升高PH值不变 |
FeCl3的水解方程式可写为FeCl3+3H2O 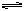 Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
| A.降低温度 | B.加入少量Na2CO3 | C.加入少量盐酸 | D.增加FeCl3的浓度 |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液。下列说法不正确的是
A.c(NH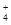 );③>① );③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
D.①和③等体积混合后的溶液:c(NH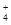 )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
不能用于判断HA是弱电解质(弱酸)的依据是( )
A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是( )
A.c(Cl-)>c(NH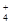 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.c(NH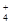 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
C.c(NH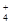 )<c(Cl-)<c(H+)<c(OH-) )<c(Cl-)<c(H+)<c(OH-) |
D.c(NH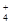 )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
可逆反应A(s)+B C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )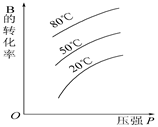
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体,正反应是吸热反应
C.B是气体,C是固体,正反应是放热反应
D.B、C都是气体,正反应是放热反应