有资料表明,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4。下列关于该元素的说法不正确的是( )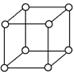
A 上图的堆积方式空间利用率太低,金属极少采取这种堆积方式
B 钋晶体中原子的配位数为6
C 钋基态原子的能层数=周期序数=价电子数
D 钋的常见化合价为+4、+6、-2价
符合如图所示的热化学方程式是()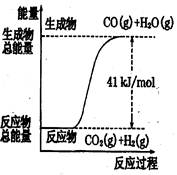
| A.CO+H2O=CO2+H2;△H="+41" kJ/mol |
| B.CO(g)+H2O(g)=CO2(g)+H2(g);;△H= −41 kJ/mol |
| C.CO2(g)+H2(g)=CO(g)+H2O(g);△H="+41" kJ/mol |
| D.CO2(g)+H2(g) =CO(g)+H2O(g);△H=−41 kJ/mol |
下列说法中正确的是 ( )
| A.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行 |
| B.某反应在高温条件下不能自发进行,那么该反应在低温条件下也一定不能自发进行 |
| C.反应方向是由焓变和熵变共同决定的,与反应温度无关 |
| D.温度有可能对反应的方向起决定性作用 |
在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="12" n(B)时,可判断x=4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
已知可逆反应X(g)+Y(g)  Z(g) (未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
Z(g) (未配平)。温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是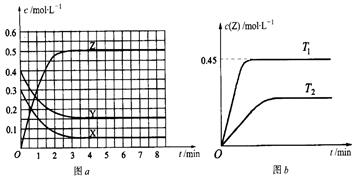
| A.图a中,各物质的反应速率大小关系为:v(X)=" v(Y)=" 2v(Z) |
| B.T0时,该反应的平衡常数为0.03 |
| C.图a中反应达到平衡时,X、Y的转化率相同 |
| D.T1时的平衡常数大于T2时的平衡常数,但小于33.3 |
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1。下列推断中正确的是
| A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 |
| B.物质的量浓度c(甲)=10c(乙) |
| C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲) |
| D.甲中的c(OH-)为乙中的c(OH-)的10倍 |