铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体不同温度下转化的图示,下列有关说法不正确的是 ( ) 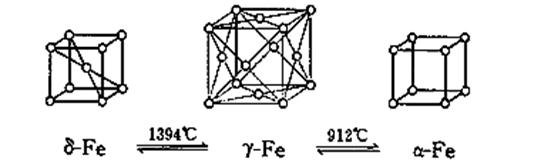
| A.δ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有8个 |
| B.γ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有12个 |
| C.α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3∶a3 |
| D.将铁加热到1500 ℃分别急速冷却和缓慢冷却,得到的晶体结构不相同,但化学性质几乎相同 |
可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是()
2NH3已达到平衡状态的是()
①一个N≡N断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体系压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L·min,逆反应速率v(NH3)=0.4mol/L·min
| A.全部 | B.只有①③④⑤ | C.②③④⑤⑦ | D.只有①③⑤⑥⑦ |
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:
3A(g) 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是()
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是()
| A.若x=2,则p>0.5a | B.若x=3,则p>0.7a |
| C.若x=4,则p= a | D.若x= 5,则p≥a |
下列有关化学反应速率的说法中,正确的是()
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
对可逆反应2SO2+O2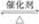 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( )
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2)∶n(O2)=2∶1 |
| B.反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 |
| C.反应达到平衡后,再加入催化剂,平衡不移动,反应速率不再加快 |
| D.当v正(SO2)∶v正(SO3)=1∶1时,说明该化学反应已经达到平衡 |
下列表格中的各种情况,可以用下图的曲线表示的是()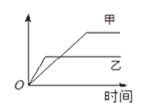
| 反应 |
纵坐标 |
甲 |
乙 |
|
| A |
相同质量的氨,在同一容器中 2NH3 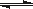 N2 + 3H2ΔH<0 N2 + 3H2ΔH<0 |
氨气的转化率 |
500℃ |
400℃ |
| B |
等质量钾、钠分别与足量水反应 |
H2质量 |
钠 |
钾 |
| C |
在体积可变的恒压容器中,体积比1︰3的N2、H2,N2 + 3H2 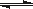 2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
| D |
2 molSO2和1 molO2,在相同温度下2SO2 + O2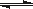 2SO3 2SO3 |
SO3物质的量 |
2个大气压 |
10个大气压 |