以下四组气体分别与对应的试纸接触,均能使试纸变蓝的是 ( )
| 选项 |
湿润的淀粉KI试纸 |
湿润的红色石蕊试纸 |
| A |
SO2 |
NH3 |
| B |
H2S |
HCl |
| C |
Cl2 |
CO2 |
| D |
NO2 |
NH3 |
某同学想要从碘的饱和水溶液中萃取碘,关于该实验的说法中不正确的是
| A.使用分液漏斗前应先检查其是否漏液 |
| B.可以选用苯、汽油、酒精和四氯化碳为萃取剂 |
| C.若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色 |
| D.分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出 |
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,溶有1.06g Na2CO3的溶液中含有的Na+ 离子数为0.02 NA |
| C.通常状况下,1 NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
A.NH4Cl + NaOH  NaCl+ H2O + NH3↑ NaCl+ H2O + NH3↑ |
| B.Fe+CuSO4=Cu+FeSO4 |
C.CH4+2O2 CO2+2H2O CO2+2H2O |
D.2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
下列叙述中正确的是
| A.1molCO的质量是28g | B.HNO3的摩尔质量63g |
C.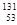 I 的中子数为53 I 的中子数为53 |
D.H2O和Al3+的核外电子总数不同 |
下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
| A.①和② | B.①和③ | C.③和④ | D.①和④ |