合成氨工业上采用循环操作的主要是因为
| A.加快反应速率 | B.能提高NH3的平衡浓度 |
| C.降低NH3的沸点 | D.提高N2和H2的利用率 |
能够鉴定溴乙烷中存在溴元素的实验操作是
| A.在溴乙烷中直接加入AgNO3溶液 |
| B.加蒸馏水,充分搅拌后,加入AgNO3溶液 |
| C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液 |
| D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液 |
航天科学家正在考虑用塑料飞船代替铝制飞船,进行太空探索,其依据是
| A.塑料是一种高分子化合物,可以通过取代反应大量生产 |
| B.塑料是有机物,不会和强酸强碱作用 |
| C.塑料用途广泛,可从自然界中直接得到 |
| D.塑料生产中加入添加剂可得到性能比铝优良的新型材料 |
现有①石油的分馏②煤的干馏 ③油脂的硬化④蛋白质的盐析 ⑤蛋白质的变性⑥橡胶的老化。其中属于物理变化的是
| A.①②④ | B.①④ | C.③④⑥ | D.①③⑥ |
下列反应中,属于取代反应的是
①CH3CH=CH2+Br2 CH3CHBrCH2Br②CH3CH2OH
CH3CHBrCH2Br②CH3CH2OH  CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3 C6H5NO2+H2O
C6H5NO2+H2O
| A.①② | B.③④ | C.①③ | D.②④ |
别在两个水槽中盛水和某液体A,再分别滴入一滴苯和水,然后用条型磁铁接近液面,并缓慢移动,水滴跟着移动,而苯滴不移动。则液体A可能为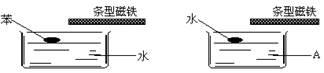
| A.煤油 | B.酒精 | C.苯 | D.四氯化碳 |