1 mol H2 (g)和1mol I2(g)置于某1 L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 2HI(g) ΔH<0,达到平衡HI的体积分数w(HI)随时间变化如图(Ⅰ)所示。若改变反应条件,w(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是
2HI(g) ΔH<0,达到平衡HI的体积分数w(HI)随时间变化如图(Ⅰ)所示。若改变反应条件,w(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是
| A.恒温恒容条件下,加入适当催化剂 |
| B.恒温条件下,扩大反应容器体积 |
| C.恒容条件下,降低温度 |
| D.恒温条件下,再加入1molHe |
铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH) 2下列有关该电池的说法不正确的是
Fe(OH)2+2Ni(OH) 2下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
下列说法或表示方法正确的是
| A.催化剂能降低正反应的活化能,但不能改变逆反应的活化能 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H = -57.3kJ•mol-1,则含1 mol NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C.由C(石墨,S)→C(金刚石,S);△H = +2.1 kJ•mol-1,可知金刚石比石墨稳定 |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=–285.8 kJ•mol-1 |
下列说法不正确的是
| A.侯氏制碱法实现了对CO2、NH3等的循环利用,而且提高了NaCl的利用率 |
| B.工业污水中的Cu2+、Hg2+等可用Na2S除去 |
| C.含有CaCl2、MgSO4的硬水,常用加热的办法进行软化 |
| D.在配制FeCl3溶液时,应先将FeCl3溶解在较浓的盐酸中,再加水稀释 |
某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀。该有机样品可能是
| A.乙二醇 | B.乙醇 |
| C.甲醇和丙三醇的混合物 | D.乙醛 |
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。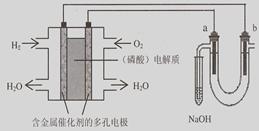
下列说法中正确的是
| A.电池工作时,负极反应式为:H2 +2 OH――2e-=2H2O |
| B.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.32g O2 时,b 极周围会产生0.04g H2 |