燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用 |
| C.乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-=2CO2↑+3H2O |
| D.H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-=2H2O |
下列有关胶体的叙述中不正确的是
| A.淀粉溶胶中胶体微粒大小在1~100nm |
| B.用一束光照射氢氧化铁胶体,可以观察到一条光亮的通路 |
| C.向沸腾的蒸馏水中加几滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热可得氢氧化铁胶体 |
| D.可以利用过滤来分离胶体粒子和溶液 |
如图所示的实验操作中,正确的是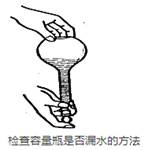

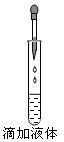
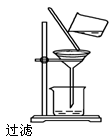
A. B. C. D.
以下是一些常用的危险品标志,装运酒精的包装箱应贴的图标是
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )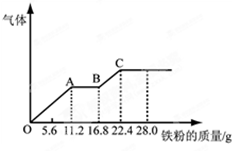
| A.H2SO4浓度为5 mol·L-1 |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.混合酸中NO3—物质的量为0.2mol |
有三个容积相同的容器①②③均发生如下反应:3A(g)+ B(g)  2C(g);△H<0,①容器容积固定,外有隔热套;②容器容积固定;③容器有活塞可移动。下列说法正确的是 ()
2C(g);△H<0,①容器容积固定,外有隔热套;②容器容积固定;③容器有活塞可移动。下列说法正确的是 ()
A.若维持温度不变,起始时②中投人3mol A、l mol B;③中投入3 mol A、l mol B和2 mol C,则达到平衡时,两容器中B的转化率②=③。
B.若起始温度相同,分别向三个容器中充入3 mol A和1mol B,则达到平衡时各容器中C 物质的百分含量由大到小的顺序为③>②>①。
C.若起始温度相同,分别向三个容器中充入1 mol A和1molB则达到平衡时各容器中C 物质的百分含量一定相同。
D.若起始温度相同,分别向三个容器中充入3a mol A 和a molB 则达到平衡时各容器中A 物质的转化率一定相同。