如图,隔板K可左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。发生反应2A(g)+B(g) 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
| A.达平衡后,隔板K最终停留在左侧刻度0~2之间 |
| B.若平衡时K停留在左侧1处,则活塞停留在右侧6处 |
| C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量 |
| D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
下列图片可以反映建国后土地制度的变迁,在这一过程中,最主要的改变是
| A.土地的使用权 | B.土地的用途 | C.土地的所用权 | D.土地的规模 |
据下图判断中国进出口总额开始出现较快增长的年代,与此同步发生的重大事件是 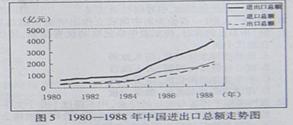
| A.设立四个经济特区 | B.开放14个沿海港口城市 |
| C.开发上海浦东地区 | D.加入世界贸易组织 |
1949年3月,毛泽东在中共七届二中全会上指出:“国营经济是社会主义性质的,合作经济是办社会主义性质的,加上私人资本主义经济,加上个体经济,加上国家和私人合作的国家资本主义经济,这些就是人民共和国的几种主要的经济成分。”这些就构成了
| A.旧民主主义的经济形态 | B.新民主主义的经济形态 |
| C.社会主义的经济形态 | D.半社会主义的经济形态 |
下图所示为1960~1965年中国工业总产值的变化,这一变化主要是由于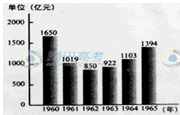
| A.经济政策的变化 | B.工业结构的调整 |
| C.农业经济的波动 | D.中苏关系的变化 |
报载,武汉工人提出“车间就是战场,工人就是战斗员,开快机器,多做一件活,就等于多消灭一个敌人”;鞍山钢铁厂工人“把行李搬到工厂,昼夜守在高炉旁……在极其艰苦的情况下,先后生产了大批军锹、军镐、炮弹钢、副油箱等,并不断改进技术,提高质量”。上述场景出现在( )
| A.抗日战争时期 | B.解放战争时期 |
| C.抗美援朝时期 | D.大跃进时期 |