在常温下,水电离的c (H+)=1×10-13 mol·L-1的无色溶液中一定能大量共存的离子组是
A NH4+、Mg2+、SO42-、Cl- B Ba2+、K+、Cl-、NO3-
C Al3+、Cu2+、SO42-、NO3- D Na+、Ca2+、Cl-、AlO2-
氰酸铵(NH4OCN)与尿素[CO(NH2)2]
| A.都是共价化合物 | B.都是离子化合物 |
| C.互为同分异构体 | D.互为同素异形体 |
下列叙述中,错误的是
| A.苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |
| B.苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
| C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
| D.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
设阿伏加德罗常数的数值为NA,则下列说法正确的是
| A.15 g甲基(—CH3)所含有的电子数是NA |
| B.0.5 mol 1,3-丁二烯分子中含有C===C键数为NA |
| C.标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA |
| D.常温常压下,1 mol丙烷所含有的共价键数目为12NA |
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是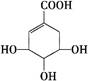
| A.分子式为C7H6O5 |
| B.分子中含有2种官能团 |
| C.可发生加成和取代反应 |
| D.在水溶液中羧基和羟基均能电离出H+ |
下列关于有机化合物的说法正确的是
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
| B.戊烷(C5H12)有两种同分异构体 |
| C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
| D.糖类、油脂和蛋白质均可发生水解反应 |