下列说法正确的是
| A.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的顺序是:①>②>③>④ |
| B.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a |
| C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+) = 2c(S2-) +2c(HS-)+2c(H2S) |
| D.常温下,若0.1mol/L NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)> c(Y2-) > c(H+)> c(H2Y) |
已知常温下,N2(g)和H2(g)反应生成2 mol NH3(g)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下,向密闭容器甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ,向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
| A.92.4>Ql>2Q2 | B.92.4=Q1<2Q2 |
| C.Q1=2Q2=92.4 | D.Q1=2Q2<92.4 |
下列实验操作或装置符合实验要求的是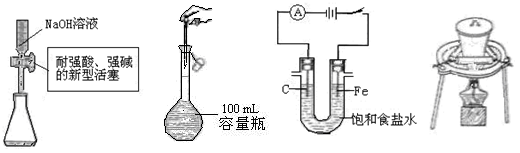
| A.量取15.00 mLNaOH溶液 | B.定容 |
| C.电解食盐水制Cl2、H2 | D.高温煅烧石灰石 |
某蓄电池充放电的反应如下:Fe + NiO2 + 2H2O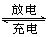 Fe(OH)2 +Ni(OH)2下列推断中正确的是
Fe(OH)2 +Ni(OH)2下列推断中正确的是
| A.放电时,Fe是正极 |
| B.充电时阴极电极反应式为:Fe ( OH )2 + 2e-=Fe + 2OH- |
| C.充电时,Ni元素被还原 |
| D.放电时溶液中OH-移向正极 |
图Ⅰ是NO2(g)+CO(g) CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ。
CO2(g)十NO(g)反应过程中能量示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ。
下列有关说法正确的是
| A.该反应的焓变△H=234 kJ·mol-1 |
| B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 |
| C.若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
| D.若X表示反应时间,则Y表示的可能是混合气体的密度 |
已知可逆反应AsO43-+2I-+2H+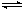 AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是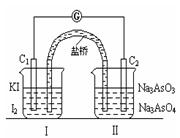
| A.①操作过程中C1棒上发生的反应为2I--2e-=I2 |
| B.②操作过程中导线上电子定向移动方向由C2→C1 |
| C.若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气 |
| D.若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极 |