某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| C.原溶液中一定含有SO42-和Na+ |
| D.反应最后形成的溶液中溶质只有Na2SO4 |
在热的稀硫酸溶液中溶解11.4g FeSO4。当加入50mL 0.50mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+。KNO3溶液也完全反应,并有NxOy气体逸出,此NxOy气体为
| A.N2O | B.N2O3 | C.NO2 | D.NO |
下列有关实验装置进行的相应实验,能达到实验目的的是
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积 |
| D.装置4可用于实验室制取乙酸乙酯 |
已知下列弱酸的电离常数:
H2CO3: Ka1=4.30×10-7;Ka2=5.61×10-11
H2SO3: Ka1=1.54×10-2;Ka2=1.02×10-7
HClO:Ka=2.95×10-8
下列离子在溶液中结合H+的能力不正确的是
A.HCO >HSO3- >HSO3- |
B.CO >SO >SO |
C.HCO >ClO- >ClO- |
D.ClO->SO |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是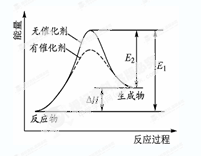
| A.该反应为放热反应 |
| B.催化剂能改变该反应的焓变 |
| C.催化剂能降低该反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
下列有关化学用语表示正确的是
| A.乙醇的结构简式 C2H6O | B.氨基的电子式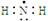 |
C.镁离子的结构示意图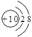 |
D.中子数为79、质子数为55 的铯(Cs)原子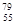 Cs Cs |