(14分)甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加人盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体。
(1) 甲、乙、丙的化学式分别为____________
(2) 250C时,PH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为______。
(3) 写出⑤中发生反应的离子方程式____________
(4) 250C时,将a mol/L CH3COOH溶液与0.02 mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)="______" (忽略混合时溶液体积的变化)。
(5) 等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该
元素的质量相等,则乙溶液和丙溶液的体枳比可能为______ (填选项字母)。
| A.3:1 | B.1:3 | C.7:1 | D.1:7 |
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
②2CH3CHO+O2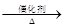 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下: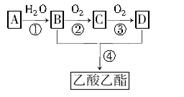
回答下列问题:
(1)A的空间构型是___________________。
(2)A、C分子中的官能团名称分别是___________、__________;
(3)写出下列反应的反应类型:①___________________②___________________,
(4)写出下列反应的化学方程式:
①___________________________________________;
②___________________________________________;
④___________________________________________;
A、B、C为短周期元素,在周期表中所处的位置如图所示。
| A |
C |
|
| B |
A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为:
请回答下列问题:
(1)写出A、B、C三种元素的符号:A,B,C。
(2)B位于周期表中第周期族。
(3)C的氢化物的电子式为;A的最高价氧化物对应水化物的化学式为。
(4)BC6作制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。已知BC6在温度高于45度时为气态。BC6属于(填“离子”或“共价”)化合物。
浙江东方化工厂生产的某产品只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
(1)该产品的结构简式为:,
(2)在一定条件下,该产品跟乙二醇反应可得到分子式为C6 H10O3的物质,该物质发生加聚反应可得到用来制作隐形眼镜的高分子材料,这种高聚物的结构简式为:。
(3)某物质M与该产品互为同分异构体,M具有下列性质:①可发生水解反应,②能使酸性高锰酸钾溶液褪色,③M为链状有机物。写出M可能的结构简式(至少写3个)
按要求完成下列试题
(1)根据系统命名法(IUPAC)命名(CH3CH2)2C(CH3)2;
(2)写出2,3-二甲基-1-丁烯的结构简式;
(3)写出丙醛和新制的氢氧化铜溶液共热的化学反应方程式;
(12分)某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、镁、铝各0.2mol分别投入到100mL的1mol/L盐酸中,试预测实验结果:
______与盐酸反应最剧烈,___与盐酸反应的速度最慢;_____与盐酸反应产生的气体体积最多(同状况下)。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律:
(2)仪器A的名称为_____,干燥管D的作用为_________。
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____的现象,即可证明。有的同学认为该实验设计不够严密,则应在B、C两装置间添加装有________溶液的洗气瓶。