【化学---选修模块:物质结构与性质】
下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)元素⑥形成的最高价含氧酸根的立体构型是________,其中心原子的杂化轨道类型是_______。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
| A.分子中含有氢键 | B.属于非极性分子 |
| C.含有4个σ键和1个π键 | D.该氢化物分子中,②原子采用sp2杂化 |
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。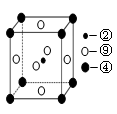
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理基污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)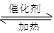 2SO3(g)△H=-198kJ•mol-1
2SO3(g)△H=-198kJ•mol-1
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.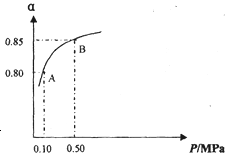
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于 _________________。
②平衡状态由A变到B时.平衡常数K(A)____________K(B)(填“>”、“<”或“=”)
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,放出的热量为:____________kJ
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度B.降低温度
C.增加NO2的浓度D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-)B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
反应A(g)+B(g)⇌C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。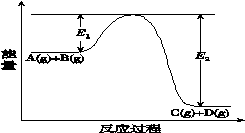
①图中E1代表的意义是_____________________。
该反应是______________反应(填“吸热”或“放热”)。反应热ΔH的表达式为________________。
②当反应达到平衡时,升高温度,A的转化率______________(填“增大”“减小”或“不变”)。
(2)800 ℃时,在2 L密闭容器内充入0.50 mol NO和0.25 mol O2,发生如下反应:2NO(g)+O2(g)===2NO2(g)ΔH<0。体系中,n(NO)随时间的变化如下表:
| t/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.50 |
0.35 |
0.28 |
0.25 |
0.25 |
0.25 |
①能说明该反应已达到平衡状态的是______________。
A.v(NO2)正=v(O2)逆B.容器内压强保持不变
C.v(NO)逆=2v(O2)正 D.容器内气体颜色不变
②能使该反应的反应速率增大,且平衡向正反应方向移动的措施是______________。
A.适当升高温度 B.缩小反应容器的体积
C.增大O2的浓度D.选择高效催化剂
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下所示: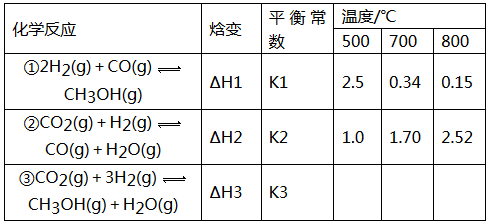
请回答下列问题:
(1)反应②是______________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_____________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有_______________(填字母序号)
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正____________v逆(填“>”、“=”或“<”).
(5)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它们在高温下能传导O2-离子,该电池的正极反应式为_________________。电池工作时,固体电解质里的O2-向_____________极移动。
(6)300℃时,在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是______________________。
A.2c1>c3 B.a+b<90.8C.2p 2<p3D.α1+α3<1
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①25℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示: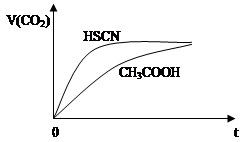
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________________.
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
②若保持温度不变,,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如右图所示,下列有关说法正确的是_______________。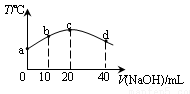
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)