【化学-物质结构与性质】
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为 ;在熔点很高的两种常见单质中,X的杂化方式分别为 、 。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第 电离能。
(4)戊的基态原子有 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)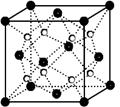
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
向纯碱溶液中滴入酚酞溶液,观察到的现象是______________ ,原因是________________________________________;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是_______________________________,原因是_______________________ ___________________。
在25℃时,有pH=a的盐酸和pH=b的NaOH溶液,取VaL盐酸与NaOH溶液中和,需VbL NaOH溶液,问:
(1)若a+b =14、则Va/Vb= (填数字)。
(2)若a+b =13、则Va/Vb= (填数字)。
(3)若a+b >14、则Va/Vb= (填数字),且Va Vb(填>、<或=)。
(4)若a+b =15、则Va/Vb= (填数字)。
某二元弱酸H2A溶液,按下式发生一级和二级电离:
H2A H++HA-
H++HA-
HA- H++A2-
H++A2-
已知相同浓度时H2A要比HA-的电离能力强,即:K1>>K2。设有下列四种溶液:
A.0.01mol.L-1的H2A溶液
B.0.01mol.L-1的NaHA溶液
C.0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
D.0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
c(H+)最大的是___________,最小的是 。
c(H2A)最大的是_____________,最小的是__________。
c(A2-)最大的是______________,最小的是___________。
把AlCl3(aq)蒸干灼热,最后得到的固体产物是什么?(用化学方程式表示,并配以必要的文字说明) 。
氯气有毒,一旦泄露会造成对空气的严重污染。工业上常用浓氨水检验氯气管是否漏气。(已知Cl2可将NH3氧化成N2)请简要说明这种检验方法的依据:
。并写出有关反应的化学方程式为。