有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中常用固体E在B的催化下加热制取气体单质H。
请回答下列问题: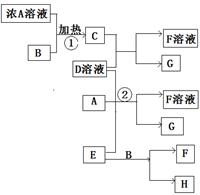
(1)反应①的化学方程式为____________________
(2)反应②的离子方程式为____________________
(3)写出另外一种实验室制取H的化学方程式_______________________
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的KSP=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合。若D的浓度为1×10-2mol/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为_______
二甲醚(
)是无色气体,可作为一种新型能源。由合成气(组成为
、
和少量的
)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)
+ 2
=
= -90.1
•
(ii) + 3 = + = -49.0 •
水煤气变换反应:
(iii)
+
=
+
= -41.1
•
二甲醚合成反应:
(iV)2
=
+
= -24.5
•
回答下列问题:
(1)
是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度
的主要工艺流程是(以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于
转化率的影响。
(3)由
和
直接制备二甲醚(另一产物为水蒸气)的热化学方程式为。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响。
(4)有研究者在催化剂(含
-
-
-
和
)、压强为5.0
的条件下,由
和
直接制备二甲醚,结果如下图所示。其中
转化率随温度升高而降低的原因是。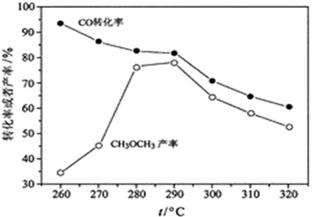
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93
•
•
)。若电解质为酸性,二甲醚直接燃料电池的负极反应为,一个二甲醚分子经过电化学氧化,可以产生个电子的能量;该电池的理论输出电压为1.20
,能量密度
=(列式计算。能量密度=电池输出电能/燃料质量,1
•
= 3.6×106
)。
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(
)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为
。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:
(1)
中,
元素的化合价为。
(2)写出"正极碱浸"中发生反应的离子方程式。
(3)"酸浸"一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式;可用盐酸代替
和
的混合液,但缺点是。
(4)写出"沉钴"过程中发生反应的化学方程式。
(5)充放电过程中,发生
与
之间的转化,写出放电时电池反应方程式。
(6)上述工艺中,"放电处理"有利于锂在正极的回收,其原因是。在整个回收工艺中,可回收到的金属化合物有(填化学式)。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物
(直径小于等于2.5
的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对
、
、
等进行研究具有重要意义。请回答下列问题:
(1)对
样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
||||||
| 浓度/ | 4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断
的酸碱性为,试样的
值。
(2)为减少
的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
写出焦炭与水蒸气反应的热化学方程式;
②洗涤含
的烟气,以下物质可作洗涤剂的是;
a.
b.
c.
d.
(3)汽车尾气中
和
的生成及转化为:
①已知气缸中生成
的反应为:

若1
空气含有0.8
和0.2
,1300℃时在密闭容器内反应达到平衡。测得
为8×10-4
.计算该温度下的平衡常数K=;汽车启动后,气缸温度越高,单位时间内
排放量越大,原因是。
②汽车燃油不完全燃烧时产生
,有人设想按下列反应除去
:
已知该反应的
,简述该设想能否实现的依据。
③目前,在汽车尾气系统中装置催化转化器可减少
和
的污染,其化学反应方程式为。
已知: ;水杨酸酯
为紫外吸收剂,可用于配制防晒霜。
的一种合成路线如下:
;水杨酸酯
为紫外吸收剂,可用于配制防晒霜。
的一种合成路线如下:
请回答下列问题:
(1)一元醇
中氧的质量分数约为21.6
。则
的分子式为;结构分析显示
只有一个甲基,A的名称为。
(2)
能与新制的
发生反应,该反应的化学方程式为。
(3)
有种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:;
(4)第③的反应类型为;D所含官能团的名称为。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式:
。
a.分子中含有6个碳原子在一条线上 b.分子中所含官能团包括水杨酸具有的官能团
(6)第④步的反应条件为;写出E的结构简式。
明矾石经处理后得到明矾【
】。从明矾制备
、
和
的工艺过程如下所示: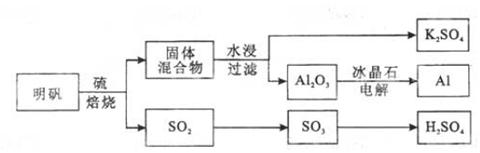
焙烧明矾的化学方程式为:
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是。
(2)从水浸后的滤液中得到
晶体的方法是。
(3)
在一定条件下可制得
,其晶体结构如右图所示,该晶体中
的配位数是。
(4)以
和
为电极,
溶液为电解液组成一种新型电池,放电时
转化为
,该电池反应的化学方程式是。
(5)焙烧产生的
可用于制硫酸。已知25℃、101
时:
;
;
。
则
与
反应的热化学方程式是。
焙烧948
明矾(
),若
的利用率为96%,可生产质量分数为98%的硫酸
。