金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其电极反应式为:Ni—2e-=== Ni2+ |
| B.电解过程中,阴阳两极得失电子总数相等,所以阳极减少的质量与阴极增加的质量也必定相等 |
| C.电解后,溶液中存在的金属阳离子只有Ni2+和Fe2+ |
| D.电解后,电解槽底部的阳极泥中有Cu和Pt |
在2A+B 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol /(L·s)B.υ(B)= 0.3 mol /(L·s)
C.υ(C)= 48 mol /(L·min)D.υ(D)= 1 mol /(L·s)
关于化学反应与能量的说法正确的是
| A.中和反应是吸热反应 | B.燃烧属于放热反应 |
| C.化学键断裂放出能量 | D.反应物总能量与生成物总能量一定相等 |
纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是
| A.大于 | B.等于 | C.小于 | D.不能肯定 |
下列离子的检验方法合理的是
| A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| C.用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若有黄色火焰产生,该固体中一定含Na+,不含K+。 |
| D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明有Cl- |
将NO2和NH3混合,在一定条件下发生反应: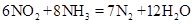 ,下列说法正确的是
,下列说法正确的是
| A.NO2被氧化 | B.NO2既是氧化剂,又是还原剂 |
| C.NO2是氧化剂 | D.1 mol NH3反应,转移3mol电子 |