(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;室温下,若生成同浓度的NaCl与NH4Cl溶液各1L, 则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
(1)H218O和D2O分子中的中子数,前者和后者的关系是(填序号,下同)
a.大于 b.小于 c.等于 d.无法确定
(2)化学变化中,可能发生改变的是
a.质子数b.中子数 c.核外电子数d.原子核
(3)右图为周期表的一部分,已知A,B,C,D,E五种元素,原子核外共有85个电子,E原子核外有四个电子层,B元素是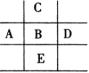
a.P b.Mg c.Cl d. Si
(14分)如图所示是电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是惰性电极。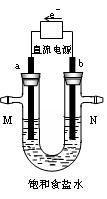
⑴a电极的名称, a电极的电极方程式为:____________.
⑵电解过程中观察到的现象。
⑶确定N出口的气体最简单的方法是,若收集N出口的气体体积在标准状况为1.12L,则电解过程中转移的电子数目为:_____________.
⑷电解的总反应离子方程式为。
⑸若将b电极换成铁作电极,写出在电解过程中U型管底部出现的现象_。
(9分)将铂丝插入稀硫酸溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池。根据两极上反应的实质判断,通入甲烷的一极为电池的___极,通入氧气的一极的电极反应式为_______________,该燃料电池放电一段时间后溶液的浓度将__________(选填“增大”,“减小”或“不变”)
(6分)一定温度下,向一固定容积的密闭容器中充入氢气和溴蒸气发生反应:H2(g)+Br2(g) 2HBr(g)。达到平衡状态后,下列说法中一定正确的是;能说明此反应达到平衡状态的是。
2HBr(g)。达到平衡状态后,下列说法中一定正确的是;能说明此反应达到平衡状态的是。
| A.单位时间内生成n mol H2的同时生成2n mol HBr |
| B.单位时间内生成n mol H2的同时生成n molBr2 |
| C.一个H-H键断裂的同时有两个H-Br键断裂 |
| D.[HBr]∶[H2]∶[Br2]=2∶2∶1 |
E.温度和体积一定时,某一生成物的浓度不再变化
F.温度和体积一定时,容器内压强不再变化
(14分) 在温度为373K时,将0.400 mol无色的N2O4气体通入4 L抽空
的密闭容器中,立刻出现红棕色,直至建立N2O4  2NO2的平
2NO2的平
衡。右图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,
横坐标为时间)(1)该反应的化学平衡常数表达式为K =。此温度下,K值=。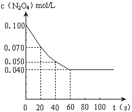
(2)计算在0至20秒时间内,NO2的平均生成速率为mol•L-1•s-1。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/ K |
323 |
373 |
| K值 |
0.022 |
? |
据此可推测该反应(生成NO2)是反应(选填“吸热”或“放热”)。
(4)若其他条件不变,反应在373K时达到平衡后,将N2O4和NO2的浓度都增加至0.4mol/L,平衡将向(填“正”或“逆”)反应方向移动。
(5) 反应在373K时达到平衡时,N2O4的转化率=_________________,若将反应容器的容积缩小为原来的一半,则N2O4的转化率将_________(选填“增大”,“减小”或“不变”)