从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”。下列既有旧化学键断裂,又有新化学键形成的变化是
| A.酒精溶解于水 | B.一定条件下O3转化为O2 |
| C.氢氧化钠晶体受热熔化 | D.溴的挥发 |
工业废气中氮氧化物是造成污染的主要来源之一.为了防治污染,工业上常通入氨气与氮氧化物反应:NOx+NH3→N2+H2O.现有NO、NO2的混合气体3L,可用同温同压下的NH3 3.5L恰好与它完全反应生成N2.则原混合气体中NO和NO2的物质的量之比为
| A.1∶1 | B.1∶2 | C.1∶3 | D.1∶4 |
下列四组混合气体(体积比) ①NO2:O2="2:1," ②NO:O2="2:1," ③NH3:O2=2:1,
④NO2:NO:O2="1:1:1," 将分别盛满上述各种气体的容积相等的四支试管倒置于盛有水的水槽中, 最后看到试管内液面上升的高度由低到高的顺序是
| A.③①④② | B.③②④① | C.④①②③ | D.③②①④ |
如右图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于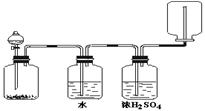
| A.浓硝酸和铜反应制备NO2 |
| B.浓氨水和生石灰反应制备氨气 |
| C.锌和盐酸反应制备氢气 |
| D.碳酸钙和盐酸反应制备二氧化碳 |
已知: 2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.519.4kJ·mol-1 | B.259.7 kJ·mol-1 | C.-259.7 kJ·mol-1 | D.-519.4kJ·mol-1 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol; Na2O2(s)+CO(g)=Na2CO3(s) ΔH="-226" kJ/mol根据以上热化学方程式判断,下列说法正确的是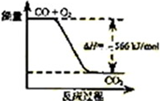
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO(s)=2Na2CO3(s) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为 6.02×1023 |