已知: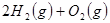
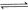
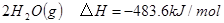
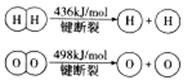
下列说法不正确的是
| A.该反应原理可用于设计氢氧燃料电池 |
| B.破坏1molH-O键需要的能量是463.4kJ |
| C.H2O(g)=H2(g)+1/2O2(g)△H="+241.8" kJ/mol |
| D.H2(g)中的H-H键比H2O(g) 中的H-O键牢固 |
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
| A.MnO4-、K+、Fe2+、H+ | B.Ca2+、HCO3-、C1-、K+ | C.Na+、Ba2+、Cl-、SO42- | D.H+、Cl-、Na+、CO32- |
下列说法正确的是
| A.0.012kg碳中所含碳原子的个数为阿伏伽德罗常数 |
| B.氢的摩尔质量为1g/mol |
| C.1molCaCO3和1molKHCO3的质量相等 |
| D.可用物质的量表示分子、原子、离子、米粒等微粒或小物质 |
某种氢气和CO的混合气体,其密度是氧气的一半,则氢气的体积百分含量为()
| A.40% | B.46% | C.50% | D.54% |
下列电离方程式中,正确的是( )
| A.K2SO4 = 2K++SO4-2 | B.Ba(OH)2 = Ba2++OH2- |
| C.Fe2(SO4)3 = 2Fe3++3SO42- | D.Mg(NO3)2 = Mg2++2(NO3)2- |
2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是 ( )
| A.取KMnO4样品时不慎在表面沾了点蒸馏水 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |