为了研究外界条件对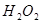 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入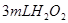 溶液,并测量收集
溶液,并测量收集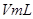 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
| 实验序号 |
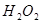 溶液浓度 溶液浓度 |
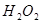 溶液温度 溶液温度 |
催化剂 |
所用时间 |
| ① |
5% |
20℃ |
2滴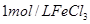 |
 |
| ② |
5% |
40℃ |
2滴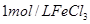 |
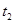 |
| ③ |
10% |
20℃ |
2滴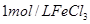 |
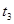 |
| ④ |
5% |
20℃ |
不使用 |
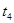 |
请回答:
(1)过氧化氢分解的化学方程式是__________。
(2)实验①②是研究__________对反应速率的影响。
(3)实验测得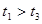 ,原因是__________。
,原因是__________。
(4)实验①④的测定过程如下图,曲线a对应的实验序号是__________(填“①”或“④”)。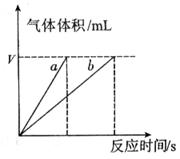
磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有。
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
① P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
② P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为。
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物。
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为单质气体,D为白色沉淀,A的化学式可能是, C与X反应的离子方程式为。
(2)若E为氧化物,则A与水反应的化学方程式为。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为,表示X呈碱性的离子方程式为。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为。
(8分)甲、乙、丙、丁四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
Cl-、SO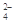 、NO3-、OH- 、NO3-、OH- |
现进行以下实验:
①将乙的溶液分别加到足量甲、丁两溶液中时均产生稳定的白色沉淀;
②将少量丙溶液滴入丁溶液时产生白色沉淀,当丙过量时沉淀完全溶解;
③甲、丙两溶液混合时产生的白色沉淀,经分析其中含有两种成份。
据此回答下列问题:
(1)写出电解质的化学式:甲乙
(2)丙物质中的化学键有,丁的阳离子的结构示意图是;
(3)写出相应离子方程式:
①甲溶液与丙溶液混合:
②乙溶液与丁溶液混合:
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O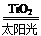 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O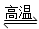 CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列说法正确的是_____。
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(9分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。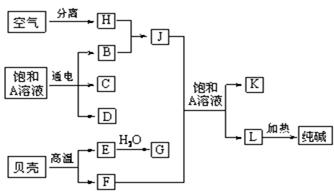
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式:。
(2) 电解A溶液反应的离子方程式为___________________________。
若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为L
(3) J分子的空间构型为______________________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:_______________________________________。