700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: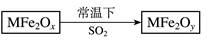
则下列判断正确的是()
| A.MFe2Ox是氧化剂 | B.SO2是该反应的催化剂 |
| C.x<y | D.MFe2Oy是还原产物 |
下列说法不正确的是()
| A.漂白粉长时间露置空气中会变质失效 |
| B.澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C.高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D.金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
随着社会的发展,人们日益重视环境问题,下列说法不正确的是()
| A.绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 |
| B.对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 |
| C.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |
| D.PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况下)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况下),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
| A.66.4 g | B.50.8 g | C.44.8g | D.39.2g |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.R氢化物的沸点高于Y氢化物的沸点 |
| B.R元素基态原子与W元素基态原子未成对电子数相同 |
| C.W与Y形成的化合物能与强碱溶液反应,但不能与任何酸反应 |
| D.R与Y形成的化合物和W与Y形成的化合物的晶体类型相同 |