常温时,纯水电离的c(H+)=a,PH=1的盐酸中由水电离的c(H+)=b,0.2 mol/L的盐酸与0.1mol/L的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是( )
| A.a﹥b=c | B.a﹥c ﹥b | C.c ﹥a﹥b | D.b﹥ c ﹥a |
某元素原子的质量数为A,它的阴离子Xn﹣核外有x个电子,w克这种元素的原子核内中子数为
A.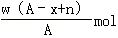 |
B. |
C.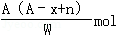 |
D.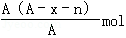 |
CH3COOH分别跟H﹣18O﹣C2H5和H﹣16O﹣C2H5酯化反应后,两者生成的水分子的相对分子质量
| A.前者大 | B.前者小 | C.相等 | D.不能确定 |
M元素的一个原子失去两个电子转移到N元素的两个原子中形成化合物Z,下列说法不正确的是
| A.M元素的离子可表示为M2+ | B.Z化学式可表示为MN2 |
| C.Z一定能溶于水 | D.Z一定为离子化合物 |
下列各分子中,化学键类型有差异的是
| A.H2O、CO2 | B.MgF2、H2O2 |
| C.NaOH、Ba(OH)2 | D.NaCl、KCl |
下列离子方程式中,正确的是
| A.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl﹣ |
| B.氯气通入冷的氢氧化钠溶液中:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O |
| C.铝片跟氢氧化钠溶液反应:Al+2OH﹣=AlO2﹣+H2↑ |
| D.金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |