氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1mol氯气中的化学键消耗的能量为Q2 kJ,形成1mol氯化氢中的化学键释放的能量为Q3 kJ。下列关系式表述合理的是( )
| A.Q1-Q2>Q3 | B.Q1+ Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+ Q2<2Q3 |
用NA表示阿伏加德罗常数,下列说法中正确的有
| A.标准状况下,22.4L H2O含分子数为NA |
| B.1 mol/L的CaCl2溶液中含Cl-的数目为2 NA |
| C.常温常压下,17g NH3含电子数目为10NA |
| D.2.7 g金属铝变成铝离子时失去的电子数为0.1NA |
下列对阿伏加德罗定律及推论的理解不正确的是



| A.同温同压下,气体的体积之比等于它们的物质的量之比 |
| B.同温同压下,气体的体积之比等于它们的质量比 |
| C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比 |
| D.同温同压下,气体的密度之比等于它们的相对分子质量之比 |
下列叙述正确的是
| A.1 mol H2的质量与它的相对分子质量相等 |
| B.CH4的摩尔质量为16g |
| C.3.01×1023个SO2分子的质量为32g |
| D.摩尔是物质的量的单位,符号为 n |
下列反应中,既属于化合反应,又属于氧化还原反应的是
A.H2 + Cl2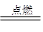 2HCl 2HCl |
B.2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| C.Na2CO3+CO2+H2O===2NaHCO3 |
| D.Zn + H2SO4 ==ZnSO4 + H2↑ |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8 g样品加入足量水,样品全部溶解,再加入过量CaCl2溶液得到9克沉淀,对样品所含杂质判断正确的
| A.肯定没有Ba(NO3)2,可能有KNO3 | B.肯定有KNO3 |
| C.肯定有Ba(NO3)2,可能有KNO3 | D.肯定没有Ba(NO3)2和Na2CO3 |