下列说法正确的是
①非极性分子中一定含有非极性键
②离子键强度由大到小: NaF> NaCl> NaBr>NaI
③配合物一定含有配位键
④Na-K合金是由Na+与K+通过静电吸引作用而形成金属键
⑤中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
| A.②③⑤ | B.②③④ | C.②④ | D.③④⑤ |
能正确表示下列反应的离子方程式的是( )
| A.硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+ CO32-=CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
下列关于碳和硅的叙述中,正确的是( )
| A.其氧化物都能与NaOH溶液反应 |
| B.其单质在加热时都能跟O2反应 |
| C.其氧化物都能溶于水生成相应的酸 |
| D.碳和硅两种元素共有两种单质 |
在1 L 1 mol·L-1的氨水中,下列说法正确的是()
| A.含有1 mol NH3分子 | B.含NH3和NH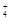 之和为1 mol 之和为1 mol |
| C.含NH3·H2O 1 mol | D.含NH3、NH3·H2O、NH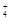 之和为1 mol 之和为1 mol |
下列金属冶炼的反应原理,错误的是 ( )
A.2NaCl(熔融) 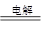 2 Na+Cl2↑ 2 Na+Cl2↑ |
B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe2O3+3CO  2Fe+3CO2 2Fe+3CO2 |
D.2HgO 2Hg+O2↑ 2Hg+O2↑ |
已知反应:①2Cl2+HgO=HgCl2+X,②X+H2O=2Y,其中X是一种黄绿色气体。下列说法中不正确的是( )
| A.Y能使湿润的有色布条褪色 |
| B.反应①是置换反应 |
| C.用强光照射Y时,Y会发生分解反应 |
| D.反应②不是氧化还原反应 |