向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 ( )
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
| C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
在一定温度下,反应

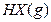 的平衡常数为9。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
的平衡常数为9。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于
| A.10% | B.18% | C.20% | D.40% |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与2.24 L O2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入100 mL NaOH溶液,此时Cu2+恰好沉淀完全,所用NaOH溶液的浓度是()mol·L-1
| A.1 | B.2 | C.3 | D.4 |
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) ="==" 2CO2(g)+2H2O(l) △H1= -870.3 kJ·mol-1
(2)C(s)+O2(g) ="==" CO2(g)△H2= -393.5 kJ·mol-1
(3)H2(g)+O2(g) ="==" H2O(l)△H3= -285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的焓变△H为()kJ·mol-1
| A.488.3 | B.-244.15 | C.244.15 | D.-488.3 |
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加
过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在
内的沉淀,再经蒸发、结晶,可得纯净的MnCl2 ,根据上述实验事实可推知MnS具
有的相关性质是
| A.具有吸附性 |
| B.溶解度与CuS、PbS、CdS等相同 |
| C.溶解度大于CuS、PbS、CdS |
| D.溶解度小于CuS、PbS、CdS |
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
| A.c(M+)>c(OH-)>c(A-)>c(H+) |
| B.c(M+)> c(A-) > c(H+)> c(OH-) |
| C.c(M+)> c(A-) > c(OH-) >c(H+) |
| D.c(M+)> c(H+) >c(A-)> c(OH-) |