(1)已知H2(g)燃烧热为-285.8kJ·mol-1用太阳能分解10mol水消耗的能量是_____________kJ;
(2)已知0.4 mol液态肼(N2 H4)与足量H2O2反应,生成氮气和水蒸气,放出256.65 kJ的热量。写出该该反应的热化学方程式__________________________________________________。
又已知 H2O(l)=== H2O(g)ΔH=+44kJ·mol-1则16g液态肼与足量H2O2反应,生成氮气和液态水放出的热量是_____________ kJ。
上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是____________________________________________________________。
298K时,合成氨反应的热化学方程式为:
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4 kJ是。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水 ,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
某烃类化合物A的质谱图表明其相 对分子质量为84,红外光谱表明分子
对分子质量为84,红外光谱表明分子 中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为;C的化学名称为;E2的结构简式是;④、⑥的反应类型依次是
 。
。
汽油不仅是重要的燃料,而且是重要的化工原料,可以通过汽油裂解得到化工原料如乙烯等,还可以在催化剂作用下改变汽油分子的结构,由链烃变为芳香烃,这种变化叫做异构化。下面是以石油为原料发生的有机物的衍变关系图:
(已知:反应③,④中的原子利用率均为100%)
请回答下列问题:
(1)上述反应①~⑦中属于加成反应的有___________________(填序号,下
同),属于取代反应的有__________________。
(2)写出A,B的结构简式:A______________,B________________。
C的分子式为_________________。
(3)写出下列反应的化学方程式:
④________________________________________________________________;
⑦____________________ ____________________________________________。
____________________________________________。
某有机化合物结构如下,分析其结构并完成下列问题: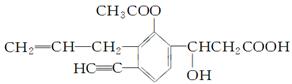
(1)写出其分子式__________。
(2)写出含氧官能团的名称________________________________。
(3)其中含有__ ___个不饱和碳原子,分子中有_______
___个不饱和碳原子,分子中有_______ _种双键,有___
_种双键,有___ _________个手性碳原子。
_________个手性碳原子。
(4)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。